Персональная таблетка
Таргетная терапия, или Атака моноклонов
Двадцать лет назад борьба с раком шла по-другому. Стратегия строилась на попытке остановить безудержный рост, учитывая способность опухолевых клеток постоянно расти и делиться. Вечный двигатель, созданный природой. Такой подход приводил к гибели здоровых тканей, делая химиотерапию токсичным и плохо переносимым видом лечения.
Первый прорыв наметился в 1970-х годах. Открытие гибридомной технологии позволило синтезировать нужное антитело практически к любому заданному антигену в лаборатории, минуя процесс иммунизации организма, да и участие иммунной системы. Это означало, что при определении ключевой «молекулы» она становилась мишенью для вновь появившихся моноклональных антител (МКАТ).
Нобелевская технология привела к появлению первого лекарства спустя 10 лет (табл. 1). Им стал muromonab для снижения реакции отторжения трансплантата.
МКАТ быстро совершенствовались, уходя от недостатков первых лекарств. Спустя десятилетие на рынок выходит первый блокбастер — rituximab, с появлением которого началась эра таргетной терапии в онкогематологии и ревматологии.
«Поражение» нужных молекул позволило управлять патологическим процессом. Мишени ширились, как и области применения МКАТ (табл. 1). Казалось, дело за малым — найти «правильную» мишень. Как оказалось, не всегда.
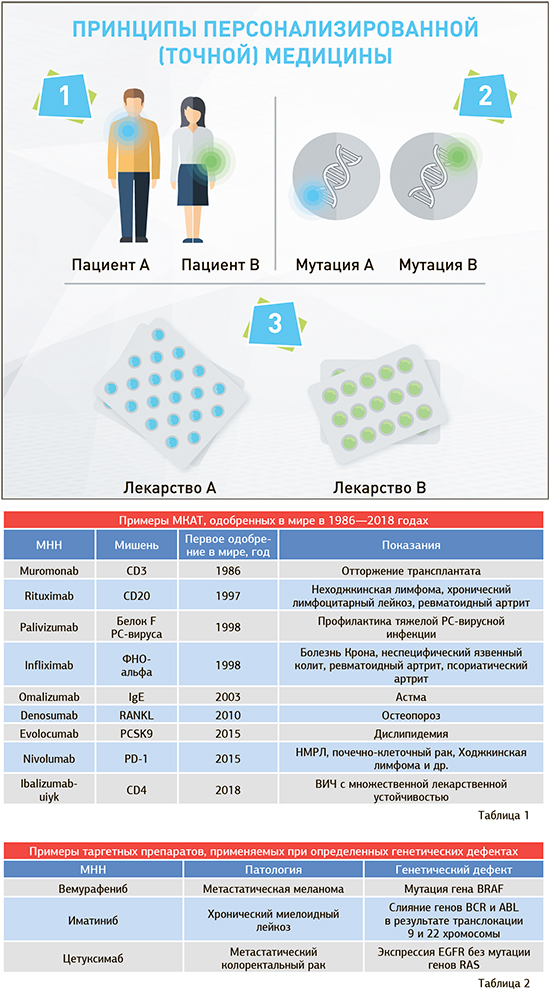
Точная медицина, или Предъявите генетический паспорт
За первым успехом последовал бурный всплеск исследований таргетной терапии. В онкологии выявили одну неприятную особенность: несмотря на одинаковый тип и стадию опухоли, эффективность препаратов отличалась от пациента к пациенту. Опухоли не однородны. Мутации, слияние генов приводят к генетическим различиям внутри одного типа опухоли, среди ключевых белков-мишеней. Это меняет эффективность препаратов и клинические исходы. Каждый «рак» имеет свою генетическую структуру.
Показательна история таргетного препарата гефитиниб — селективного ингибитора тирозинкиназы рецептора EGFR. После одобрения FDA в 2003 году для лечения немелкоклеточного рака легких (НМРЛ), спустя два года следует отзыв. Однако препарат возвращается в качестве первой линии терапии уже для лечения пациентов с мутациями EGFR, выявленными при заболевании.
Открытие генетической неоднородности опухолей трансформировало подходы к лечению. Это дало толчок к развитию персонализированной, точной медицины, когда лечение адаптировано под генетические особенности конкретного пациента (рис.).
Понимание генетических закономерностей переориентировало разработки лекарств в сторону таргетных препаратов против редких мутаций (табл. 2). Их назначение возможно после изучения генетического портрета опухоли. Следующий рубеж — индивидуальное лекарство для одного человека. Хотя и он недавно взят: в октябре в журнале NEJM опубликован отчет о создании препарата индивидуально для Милы Маковец с редким генетическим заболеванием — болезнью Баттена.
____________________
* От англ. target — мишень.






























Нет комментариев
Комментариев: