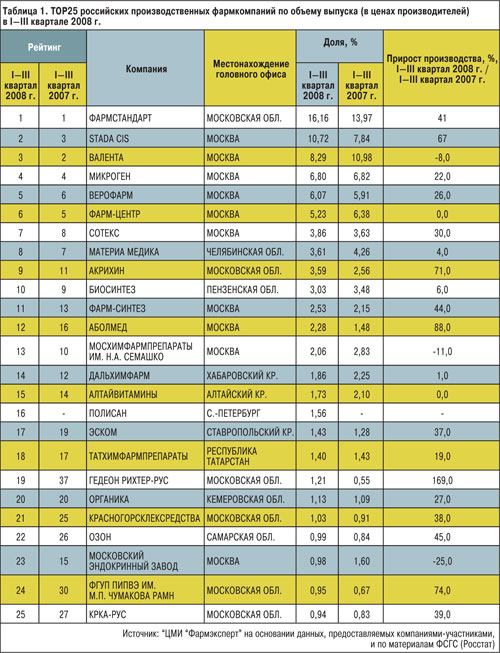
Курс на стратегические изменения. Рейтинг российских фармпроизводителей в I—III квартале 2008 года
Несмотря на активные обсуждения мировой экономической обстановки, ее влияния на различные сферы жизни, в фармацевтической отрасли не остался незамеченным факт опубликования проекта Стратегии развития фармацевтической промышленности до 2020 г. Целью этой стратегии, разрабатываемой Минпромторгом России, является переход отрасли на инновационный путь развития. Переход к инновационной модели развития фармотрасли необходим для укрепления позиций отечественных производителей на российском рынке. Этого можно достичь благодаря реализации комплекса мер, включающего принятие и реализацию стратегии развития, государственную поддержку (в частности, совершенствование правовой базы) и стимулирование развития со стороны различных ассоциаций, в т.ч. посредством лоббирования интересов на государственном уровне.
Изменения в фармотрасли должны коснуться не только производственного сегмента, но и законодательной, налоговой и правовой базы, поэтому действия и финансовые затраты обещают быть довольно масштабными.
Решение ряда задач в рамках проекта вышеупомянутой стратегии требует значительных изменений не только в системе здравоохранения. Тем не менее в целях повышения конкурентоспособности и укрепления позиций российских производителей, вне зависимости от принятия стратегии, необходимо взять курс на реализацию следующих мер:
- Оптимизация законодательной базы, в т.ч. порядка регистрации ЛС и др.
- Технологическое перевооружение предприятий в рамках перевода производства на международные стандарты GMli.
- Использование политики протекционизма в отношении отечественных производителей при определении приоритета закупок лекарственных средств для госпрограмм.
- Подготовка специалистов необходимого уровня для работы в отрасли; формирование современной научной базы.
В настоящее время процесс регистрации ЛС является неоправданно длительным. На его пути стоят многочисленные административные барьеры, усложняющие выход новых продуктов на рынок. Изменения в правовой базе могут упростить и ускорить процесс регистрации отечественных лекарств, но при этом необходимо сохранение контроля качества продукции.
Приведение российского производства к стандартам GMP необходимо; однако, несмотря на то что ср...





























Нет комментариев
Комментариев: