Как найти золотую середину для ЖНВЛП

В начале августа 2025 года комиссия Минздрава по формированию лекарственных перечней рекомендовала включить в Перечень ЖНВЛП препарат пэгунигалзидаза альфа, который применяется в качестве ферментозаместительной терапии (ФЗТ) при болезни Фабри. Одобрение комиссией было основано на том, что стоимость годового курса ниже по сравнению со стоимостью других препаратов ФЗТ — агалсидаза альфа и агалсидаза бета. Позже было решено пересмотреть этот препарат в связи с вновь открывшимися обстоятельствами.
Случай на заседании
Если следовать логике Постановления Правительства РФ № 871 от 28.08.2014, которое устанавливает правила формирования лекарственных перечней, то кандидат на включение в список ЖНВЛП должен обладать клиническими преимуществами по сравнению со стандартной терапией, а его курсовая стоимость не должна приводить к росту бюджетных расходов по данной нозологии. То есть организаторам здравоохранения хотелось бы за те же деньги обеспечить всех пациентов более эффективными препаратами.
В реальности не всегда бывает все так гладко. На заседании комиссии в августе 2025 года при рассмотрении препарата пэгунигалзидаза альфа представители медицинского сообщества рекомендовали включить его в Перечень ЖНВЛП, указывая на то, что его можно применять, когда другие ферментозаместительные препараты перестают работать, если, например, появятся антитела или разовьются нежелательные реакции.
В то же время специалисты Центра экспертизы контроля и качества медпомощи (ЦЭККМП) Минздрава отметили, что у препарата такая же терапевтическая эффективность, как и у других видов терапии. То есть на заседании не было заявлено о клиническом преимуществе, а было лишь желание врачей иметь в своем арсенале еще один препарат.
Однако предложенная цена была выше стоимости стандартной терапии, поэтому члены комиссии усомнились в целесообразности включения. Тогда производитель пэгунигалзидаза альфа компания Chiesi предложила скидку — 34%. Специалисты ЦЭККМП сделали перерасчет и оказалось, что, если взять пациента с массой тела 77 кг, таков вес среднестатического россиянина, то стоимость пэгунигалзидазы альфа ниже на 2% по сравнению с агалсидазой бета. Комиссия проголосовала за.
Конкурент или нишевый игрок
При более внимательном рассмотрении оказалось, что выгода не столь очевидна. На это обратил внимание отечественный производитель препарата агалсидаза бета. Президент «Петровакс Фарм» Михаил Цыферов рассказал комиссии, что у препаратов одинаковый режим дозирования — 1 мг на кг массы тела пациента. При этом стоимость 1 мг отличается — агалсидаза бета стоит 3 213,7 руб., а пэгунигалзидаза альфа — 4 120,1 руб.
Поскольку у лекарств разная фасовка, то стоимость одного введения меняется в зависимости от массы тела пациента. Для веса от 65 до 70 кг препарат «Петровакса» дешевле на 47%, для 71—80 кг лекарство от Chiesi дешевле на 2%, а в диапазоне 81—85 кг дешевле вновь препарат «Петровакса» — на 22%. В итоге, если взять 20 пациентов с весом от 65 до 85 кг, то по суммарным затратам на 14% выигрывает отечественный препарат.
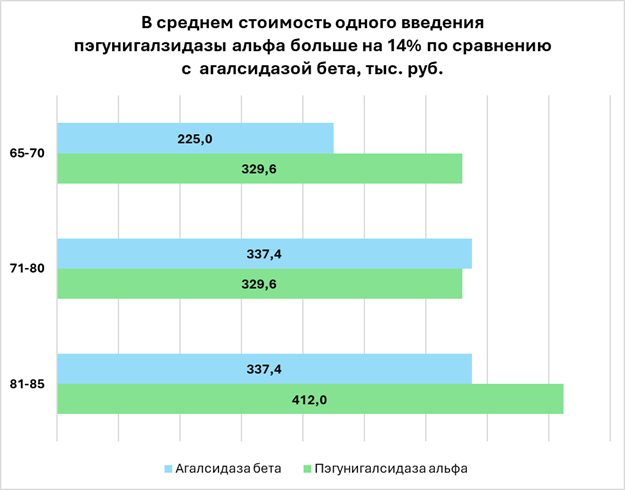
Источник: расчеты «ФВ»
Клиницисты заверяют, что новый препарат будет назначаться только определенной популяции пациентов, но документально это нигде не зафиксировано. В клинических рекомендациях (КР) пэгунигалзидазы альфа пока нет. По словам главного внештатного специалиста по медицинской генетике Минздрава, директора Медико-генетического научного центра (МГНЦ) им. акад. Н.П. Бочкова академика РАН Сергея Куцева, препарат уже есть в проекте новых КР, где и будет описана специфика его назначения. Но проблема в том, что пока статус клинических рекомендаций не до конца определен и врачу ничего не мешает назначить препарат в соответствии с инструкцией.
В инструкции по применению пэгунигалзидазы альфа указывается, что он показан для длительной ФЗТ у взрослых пациентов, у препарата агалсидаза бета то же показание — «для длительной ферментозаместительной терапии у пациентов с подтвержденным диагнозом болезни Фабри». Разница только в том, что агалсидаза бета разрешена для детей с восьми лет.
Получается, что на рынок вышел препарат с таким же показанием, как у традиционной терапии и назвать его нишевым, то есть применяемым только для определенной когорты пациентов, нельзя.
Евгений Филиппов, д. м. н., профессор, главный кардиолог Минздрава Рязанской области:
— «Золотой стандарт» лечения болезни Фабри — ферментозаместительная терапия. То есть тот фермент, которого не хватает, вводится для того, чтобы замедлить или остановить прогрессирование заболевания.
Вывод российской разработки агалсидазы бета — коллосальный прорыв с точки зрения доступности терапии. Благодаря снижению цены на отечественный препарат пациенты стали получать терапию, причем без перерыва. По сравнению с ситуацией десятилетней давности, это не просто прорыв — это бесперебойное, бесшовное обеспечение пациентов.
Что написано в инструкции
Этот вывод подтверждается результатами исследований. В инструкции пэгунигалзидазы альфа приводятся результаты рандомизированного двойного слепого исследования BALANCE, где новый препарат напрямую сравнивался с терапией агалсидазой бета. «На основании данных исследования BALANCE нельзя сделать окончательный вывод о не меньшей эффективности (non-inferiority) по сравнению с агалсидазой бета», — говорится в инструкции. Non-inferiority — статистический термин, означающий, что новый препарат не хуже препарата сравнения.
Эффективность оценивали по динамике расчетной скорости клубочковой фильтрации (рСКФ — показатель для оценки функции почек) на 12-й месяц терапии. В инструкции отмечается, что данные для сравнения на этой временной точке оказались недостаточно информативными из-за особенностей дизайна и небольшого числа участников. При этом к 24-му месяцу динамика рСКФ в группах пэгунигалзидазы альфа и агалсидазы бета была сопоставимой.
Что же касается иммуногенности, то антитела формируются к обоим препаратам. В исследовании BALANCE к концу наблюдения в группе пэгунигалзидазы альфа антитела обнаружили у 40% мужчин и 5% женщин. В группе агалсидазы бета антитела выявили у 38% мужчин, тогда как у женщин из этой группы антител не было.
Как отмечается в инструкции к агалсидазе бета, антитела вырабатывались в течение первых трех месяцев терапии. Далее у 35% серопозитивных пациентов титр оставался стабильным, у 40% снижается, а у 14 % антитела полностью исчезали.
Как поступили другие страны
Пэгунигалзидаза альфа была одобрена в Евросоюзе и США в 2023 году. По данным ресурса citeline.com, к июлю 2024 года расходы на препарат возмещались в 17 странах. В частности, в сентябре 2023 года пэгунигалзидазу альфа к возмещению рекомендовал британский NICE. В решении отмечалось, что клиническая эффективность и переносимость нового препарата сопоставимы с уже применяемыми средствами, однако его стоимость ниже. Размер скидки для Великобритании не раскрыт.
В мае 2023 года Национальный центр фармакоэкономики Ирландии (NCPE) рекомендовал не рассматривать пегунигалсиадазу альфа для возмещения расходов по заявленной цене. Однако уже в сентябре 2023 года, после переговоров о цене, препарат был все-таки одобрен. Точная стоимость препарата не раскрывается.
Во Франции расходы на препарат не возмещаются, аналогичное решение было принято и в Германии. Федеральный объединенный комитет Германии, куда входят ассоциации врачей, больниц, фондов обязательного медицинского страхования, в марте 2024 года опубликовал резолюцию, посвященную оценке эффективности пегунигалсидаза альфа. В документе указывается, что для взрослых с подтвержденным диагнозом болезни Фабри дополнительная польза не доказана. В документе говорится, что решение основано на результатах исследования BALANCE.
Тонкий лед
Многие регуляторы здравоохранения отмечали, что пэгунигалзидаза альфа — это дополнительная опция для лечения болезни Фабри, сопоставимая по эффективности и безопасности с существующими ФЗТ. Рассматривать ее включение в систему возмещения расходов можно при условии приемлемой цены. Такой подход также связан с риском перебоев в поставках ферментозаместительных препаратов, которые уже происходили несколько лет назад.
В России другая ситуация. Препарат по полному циклу выпускается внутри страны, субстанцию производит Институт им. Гамалеи, поэтому риск дефектуры не столь очевиден.
По мнению Цыферова, в этом конкретном случае интересы пациентов полностью учтены. Пегунигалсиадаза альфа зарегистрирована в России. В случае необходимости врачебная комиссия может назначить этот препарат в тех редких случаях, о которых говорят клиницисты. Основная же популяция пациентов может получить отечественную терапию без риска, что препарат исчезнет, по приемлемой для государства цене — ниже стоимости оригинального препарата.
Он добавил, что «Петровакс» инвестировал немалые средства (более 3 млрд руб.) в трансфер технологий, производство субстанции. «Наверное, нам было бы проще просто поставлять зарубежный препарат, но мы откликнулись на призыв к импортозамещению. Хотелось бы, чтобы этот момент учитывался при принятии таких сложных решений», — заключил президент «Петровакса».
Пегунигалсиадаза альфа будет повторно рассмотрена для включения в Перечень ЖНВЛП в ноябре 2025 года.






























