Как решить проблемы аптечного изготовления
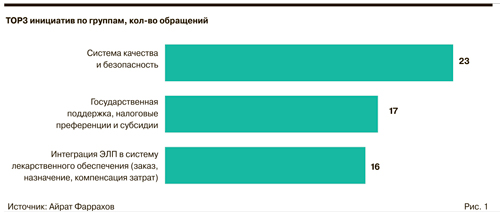
Какие поступили предложения
В конце января прошло первое заседание рабочей группы Комитета Государственной думы по охране здоровья, посвященное производственным аптекам.
Закон, легализующий их деятельность, был подписан 14 декабря 2022 года Президентом России Владимиром Путиным. Документ вступит в силу 1 сентября 2023 года — это значит, что законодательную базу необходимо принять к этому сроку.
По словам автора закона, депутата Айрата Фаррахова, в адрес рабочей группы поступило более 70 предложений по поддержке работы производственных аптек.
Фасовка субстанций
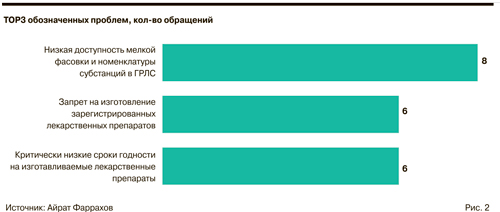
Одна из ключевых проблем производственных аптек — большие объемы субстанций, которые приходится закупать для изготовления препаратов. Участникам рынка необходима мелкая фасовка.
«С Минпромторгом мы работаем над этой темой, и существует принципиальное согласие со стороны фармацевтических производителей фасовать в более доступные мелкие объемы», — отметил зам. министра здравоохранения Сергей Глаголев.
Ограничения по фасовке субстанций возникли из-за требований таможни, уточнил советник министра промышленности Алексей Алехин.
«В 61-м федеральном законе у нас напрямую не сказано, что при включении в ГРЛС субстанций для реализации необходимо указывать размер фасовки. Этих слов там нет, — объяснил он. — Получается, что у нас запись в ГРЛС возникла как необходимость исключительно по требованию Федеральной таможенной службы, которая говорит, что нам необходимо сличать поставляемые через границу лекарственные препараты, определять их подлинность. И поэтому, помимо надписи на этикетке в банке с белым порошком, нам хотя бы нужно понимать, что это за объем».
Если перефасовка осуществляется в условиях GMP на производственных предприятиях, то эквивалентность и качество субстанции не вызовет сомнений, уверен Алехин.
Изготовление зарегистрированных препаратов
Минздрав выступает против изготовления уже зарегистрированных препаратов, которые производят заводы в больших объемах. «Задача аптечного производства — нишевое заполнение, это производство тех препаратов, которые не вошли в состав промышленного ассортимента», — отметил Глаголев.
В Минпромторге предлагают законодательно закрепить исключение из этого правила. «Например, если мы будем принимать такое решение о необходимости покрытия дефектуры как один из промежуточных этапов», — пояснил Алехин.
С этим согласны и во Всероссийском союзе пациентов. «За время разработки законопроекта появилась новая тема — дефектура. Поэтому у нас должна быть прописана, четко урегулирована возможность производства зарегистрированных препаратов в особых случаях», — отметил сопредседатель союза Юрий Жулев.
В какие законы нужно внести изменения
Рабочей группе необходимо разделить «быстрые» методы коррекции (обновление подзаконных актов) и длительное совершенствование федерального законодательства, чтобы «не увязнуть» в правовой базе, отметил Глаголев.
Первым принятым документом должны стать обновленные правила изготовления лекарственных средств в аптеках (приказ № 751н). Этот документ должен быть зарегистрирован Минюстом 1 июля. «И у нас на самом деле достаточно мало времени на то, чтобы поправить старую редакцию приказа в соответствии с нормами надлежащей производственной практики», — сказал зам. министра.
Второй документ «очереди» — общие фармакопейные статьи, уверена руководитель Федерального центра планирования и лекарственного обеспечения Елена Максимкина. «Они затрагивают требования к обеспечению качества лекарственных препаратов в целом. И там выделены моменты, связанные с лекарственными препаратами, изготавливаемыми в условиях аптечных организаций», — отметила она.
Чтобы аптечные препараты могли попасть в госзакупки, необходимо дополнить справочник — классификатор лекарственных препаратов в КТРУ разделом мануальных прописей.
По словам Максимкиной, в каталоге должны появиться как товары (прописи), так и услуги (аптечное изготовление). «Пока там есть только промышленное производство. Нужна доработка с этой точки зрения возможности закупки, это обязательный момент», — сказала она.
Идет работа над документами
Национальная фармпалата и представители научно-педагогического сообщества на базе приказа № 751н разработали правила изготовления лекарственных препаратов для медицинского применения аптечными организациями. Документ направлен в Минздрав.
В проекте приказа изложены правила изготовления препаратов из готовых лекарственных форм. «Например, для этого нельзя использовать таблетки с кишечнорастворимой оболочкой или препараты пролонгированного действия», — рассказала исполнительный директор Национальной фармпалаты Елена Неволина.
Документ определяет последовательность операций — с чего начинается изготовление из таблетки. «Самая главная новелла — из этого приказа должны быть исключены гомеопатические лекарственные формы. Иначе он вступит в прямое противоречие с Федеральным законом № 61, поскольку при изготовлении этих препаратов предполагается использовать растения, которые не входят в фармакопею, кровь и органы животных. Научно-педагогическое сообщество настаивает на исключении раздела, который включал гомеопатию», — сообщила Неволина.
Эксперты внесли предложения по расширению сроков годности субстанций, которые используются для внутриаптечной заготовки. Они предлагают наделить этим правом органы управления здравоохранением субъектов, которые будут учитывать климатические и природные условия.
«Что касается самих лекарственных форм, то для увеличения сроков годности нужно проводить масштабные исследования», — добавила Неволина.
Мониторинг рынка
Рабочей группе необходим всесторонний мониторинг рынка, отметил проректор Санкт-Петербургской химико-фармацевтической академии Захар Голант. Речь идет не о выданных лицензиях, а о том, сколько организаций в регионах фактически занимаются изготовлением препаратов.
По данным Росздравнадзора, согласно выданным лицензиям, на рынке присутствует 1044 производственные аптеки. Они работают в 84 субъектах страны.
Наличие лицензии не говорит о том, что аптека ведет эту деятельность, согласилась зам. директора Департамента лекарственного обеспечения и регулирования обращения медицинских изделий Минздрава России Светлана Семечева. Она выразила готовность собрать данные региональных минздравов о том, сколько аптек работает на рынке и сколько экстемпоральных препаратов они производят.
«Не убить то, что осталось на рынке, поддержать аптеки — одна из наших задач», — отметил Голант.
А директор СРО «Ассоциация независимых аптек», глава Альянса фармацевтических ассоциаций Виктория Преснякова напомнила экспертам о случаях, когда производственные аптеки оказывались на грани закрытия из-за бездействия региональных властей. «К нам обратился Алтайский край (Бийск), где аптечному производству как раз грозит закрытие, — сообщила она. — То в Сургуте, то в Бийске возникают такие вопросы в то время, когда мы, наоборот, занимаемся тем, чтобы помочь этому производству, чтобы оно стало нашим незаменимым партнером, к примеру, в педиатрии».
Минздрав намерен разослать в регионы письмо о необходимости поддержки производственных аптек, добавила Семечева.
Вопросы без ответов
«За кадром» первого заседания рабочей группы остались вопросы о включении экстемпоральных форм в программы госзаказа, финансирования за счет средств ОМС.
«Мы должны четко понять: экстемпоральное лекарственное средство — это все-таки препарат или это услуга? Соответствующим образом будет формироваться тогда бюджет, соответствующим образом будут формироваться подходы», — отметил Алехин.
У пациентов есть возможность получить лекарственные средства, изготовленные в аптечных организациях, за счет бюджета субъекта.
«Ограничения тут тоже есть. Во-первых, это, как правило, льготная категория граждан, которые могут получить оплаченный государством рецепт. Во-вторых, пациенты ограничены субъектом Российской Федерации, в котором лекарственное средство им выписывается и должно быть изготовлено», — констатировал Алехин.
Например, пациент, прописанный в Московской области, не может получить по льготе лекарственное средство, изготовленное в аптечной организации Москвы.
Представитель Минпрома назвал это ограничением, поскольку не все аптечные организации имеют на сегодняшний день в достатке весь ассортимент фармацевтических субстанций. «Возьмем пациентов с орфанным заболеванием «нарушения цикла мочевины». Это, как правило, дети первых трех лет жизни, и им показан высокодозный бензоат натрия в форме сиропа или в форме суппозиториев. Московские пациенты получают это лекарственное средство бесплатно, а из Мытищ и Нижнего Новгорода — за оплату», — привел пример Алехин.
Фаррахов считает ситуацию с неравномерной доступностью нишевых лекарственных препаратов катастрофой. «Это нарушение конституционных прав граждан. И если в Москве все организовано, и люди получают эти лекарственные препараты, в том числе орфанные, бесплатно, то в других субъектах нам очень важно это все организовать», — сказал депутат.
Пока без врачей
На первом заседании рабочей группы не было представителей врачебного сообщества. Внедрение экстемпоральных препаратов в клиническую практику в рамках рабочей группы согласилась курировать зам. председателя Комитета по охране здоровья Татьяна Соломатина.
«Готовы ли медицинские работники к тому, чтобы выписывать те формы и те наименования лекарств, которые в этом году уже будут производиться в этих аптеках? Мы уже забыли про то, какие это препараты и как они делаются. Самое важное — работать в комплексе», — отметил первый зам. председателя Комитета по охране здоровья Леонид Огуль.






























Нет комментариев
Комментариев: 1
Так, в соответствии с приложением N 2 к Критериям, установленным ПП РФ №1049, значение показателя риска определяется путем сложения баллов .
Например, согласно п. 7 Критериев (приложению N 1) для розничной торговли лекарственными препаратами для медицинского применения, аптека готовых лекарственных форм которая осуществляет процесс: хранения лекарственных средств (4 балла); перевозки (4 балла); отпуска (3 балла), реализации (5 баллов) и уничтожения (3 балла) в сумме сложения получит 19 баллов и по значению показателя риска будет отнесена к умеренному риску (от 15 до 20 баллов).
В то же время, если эта аптека решит восстановить изготовление хотя бы одной единицы рецептурного препарата в асептических условиях с соблюдением всех правил (например, детям до 1 года с врожденными аномалиями измельчить 1 таблетку дигоксина 0,25 off-label и поделить на дозы из расчета 8 мкг/кг) в сумме сложения получит 37 баллов (хранения лекарственных средств - 7 баллов; перевозки - 4 балла; отпуска - 3 балла, реализации - 10 баллов, уничтожения - 3 балла, изготовление – 10 баллов) и по значению показателя риска будет отнесена к значительному риску (свыше 28 баллов). В отношении объектов контроля, отнесенных к категории значительного риска, плановые проверки проводятся 1 раз в 3 года (ПП РФ №1049).
Фактически, профессиональная деятельность фармацевтического работника отнесена разработчиками ПП РФ №1049 априори к опасной деятельности в отсутствии обоснования. Полагаем, было бы логичным показатели риска установить в зависимость от количества рецептов для индивидуального изготовления лекарств, количества рецептов на готовые лекарства т.е. с учетом потенциального масштаба распространения вероятных негативных последствий, влекущих причинение вреда (ущерба).
В противоположность фармацевтической деятельности медицинская деятельность частной формы собственности не могут быть отнесены к значительному риску и, соответственное, к регулярным контрольным мероприятиям.
Оптика (широко распространенная медицинская услуга)
Суммирование значения показателей риска по: медицинской оптике (48 балла); офтальмологии (1540 баллов) в сумме сложения получит 1588 балла и по значению показателя риска будет отнесена к низкому риску (менее 21300).Плановые проверки не проводятся (ПП РФ №1048).
Лабораторная диагностика (широко распространенная медицинская услуга, в т.ч. по франшизе)
Суммирование значения показателей риска по акушерскому делу (385 баллов); по гистологии (192 балла); по лабораторной диагностике (241 балл); по сестринскому делу (289 баллов); по сестринскому делу в педиатрии (289 баллов). по акушерству и гинекологии – 5293 балла; по урологии (4764 балла); по ультразвуковой диагностике (2647 балла); по клинической лабораторной диагностике (2647 баллов); по лабораторной генетике (2117 баллов); патологической анатомии (1588 баллов) в сумме сложения получит 20452 балла и по значению показателя риска будет отнесена к низкому риску (менее 21300).
Даже хирургическое лечение пациентов в том числе нарушениями мозгового кровообращения, заболеваниями артерий и вен, острым коронарным синдромом и ишемией в частных сердечно-сосудистый центрах не отнесено к значительному риску.
Суммирование значения показателей риска по: анестезиологии и реаниматологии (5293 балла); кардиологии (4234 балла); неврологии (3705 балла); организации здравоохранения и общественному здоровью (1588 баллов), эпидемиологии (1059); рентгенологии (3176); рентгенэндоваскулярным диагностике и лечению (5293); сердечно-сосудистой хирургии (5293); сестринскому делу (3176); терапии (3705); ультразвуковой диагностике (2647); функциональной диагностике (1059); хирургии (5293); сердечно-сосудистой хирургии (4812); экспертизе временной нетрудоспособности (48 балла) в сумме сложения получит 50 381 балла и по значению показателя риска будет отнесена к умеренному риску (от 21300 до 89100). Проверки проводятся 1 раз в 6 лет (ПП РФ №1048).