FDA одобрило гель для лечения пациентов с пограничным и дистрофическим буллезным эпидермолизом
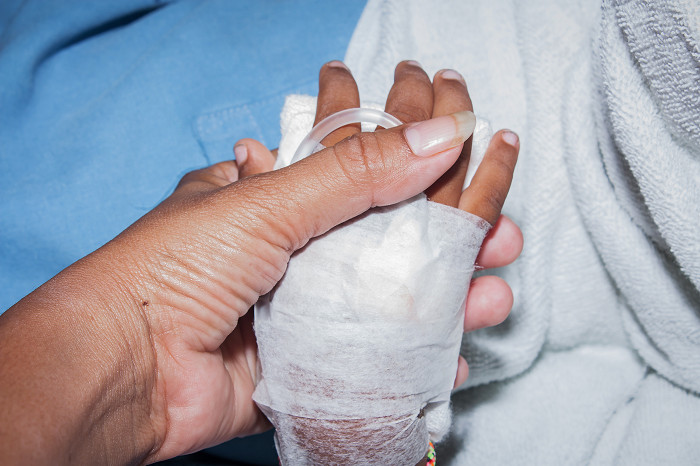
Filsuvez — первый препарат, одобренный для лечения ран при пограничном буллезном эпидермолизе, редкой форме БЭ средней и тяжелой степеней течения с образованием пузырей, возникающих в первый год жизни ребенка, и второй одобренный препарат для лечения пациентов с дистрофическим буллезным эпидермолизом после одобрения регулятором препарата после утверждения препарата «Vyjuvek»* в мае нынешнего года.
В компании Chiesi подчеркнули важную роль партнерства с Debra of America в одобрении препарата.
По словам исполнительного директора Debra of America Бретта Копелана, одобрение FDA геля Filsuvez— «еще один результат, достигнутый сообществом поддержки пациентов с БЭ». В организации выразили благодарность компании Chiesi «за огромный труд, преданность делу и пациентскому сообществу на пути подготовки препарата Filsuvez к регистрации».
«Сейчас, используя несколько опций терапии, мы находимся на пути к более эффективному лечению БЭ, при котором заболевание перейдет в хроническую, но совместимую с жизнью форму», — заключил Копелан.
Дополнительная информация опубликована в официальном сообщении Chiesi.



























