В будущее берут не всех
Пилотный проект «второго лишнего» может дать преимущество на госторгах четырем компаниям

Министерство промышленности и торговли разработало проект постановления правительства, который вводит механизм «второй лишний». Согласно правилу, если на госторги выходит хоть один поставщик препарата, который производится на территории стран Евразийского экономического союза, начиная с синтеза молекулы действующего вещества, то заказчик отклоняет все остальные заявки. Если таких поставщиков окажется несколько, они будут соревноваться между собой по стоимости.
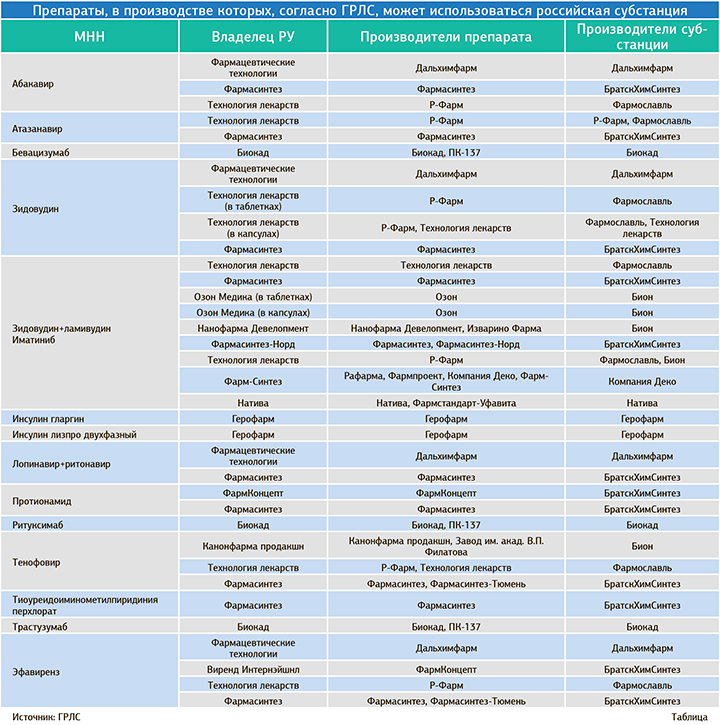
Сначала «второй лишний» опробуют при закупке 15 лекарственных средств из Перечня стратегически значимых лекарственных препаратов (СЗЛС), производство которых должно быть обеспечено на территории России: абакавир, атазанавир, бевацизумаб, зидовудин, зидовудин+ламивудин, иматиниб, инсулин гларгин, инсулин лизпро двухфазный, лопинавир+ритонавир, протионамид, ритуксимаб, тенофовир, тиоуреидоиминометилпиридиния перхлорат, трастузумаб и эфавиренз.
Механизм не будет распространяться на заявки, которые содержат предложения о поставке оригинальных или референтных лекарственных препаратов, указано в документе.
Ведомство выработало критерии для определения пилотного списка препаратов, следует из пояснительной записки. В частности, доля отечественного препарата в общем объеме продаж в рамках рассматриваемого МНН в упаковках должна превышать 50%.
Минпромторг не раз указывал, что необходимо снижать зависимость российских компаний от импортных субстанций. По мнению ведомства, такая мера будет стимулировать развитие производств полного цикла.
Обсуждение документа продлится до 3 декабря.
По мнению президента компании «Активный Компонент» Александра Семенова, предложенный перечень недостаточен, чтобы закрыть потребности страны и стимулировать развитие отрасли. «Мне кажется, эти позиции выбрали в качестве пробного шага, чтобы найти компромиссное решение», — отметил он.
Сейчас компания не производит активные фармсубстанции (АФС) ни для одного из отобранных Минпромторгом 15 препаратов, но планирует выпустить на рынок одну из них в ближайшее время, уточнили в пресс-службе «Активного Компонента».
Кто заберет закупки
«ФВ» выяснил, кто станет основными поставщиками 15 препаратов из списка. Так, если «второй лишний» вступит в силу, единственным поставщиком инсулина гларгина и инсулина лизпро двухфазного станет «Герофарм», который производит их по полному циклу. Это следует из данных Госреестра лекарственных средств.
По итогам 2020 года, согласно данным аналитической компании AlphaRM, доля компании в закупках инсулина гларгина была совсем небольшой — 12,3% в рублях и 17,7% в упаковках, а инсулина лизпро двухфазного — 19,8% в рублях и 20,1% в упаковках. Большую часть препаратов поставили производители оригинальных препаратов — Sanofi и Eli Lilly.
«Биокад» заберет три позиции: бевацизумаб, ритуксимаб, трастузумаб. При этом петербургский производитель уже поставляет большую часть этих препаратов на госторгах. По информации AlphaRM, в 2020 году доля «Биокада» в госзакупках бевацизумаба составила 84% в рублях и 84,1% в упаковках, ритуксимаба — 72,7% в рублях и 49,5% в упаковках, а трастузумаба — 68,6% в рублях и 71,2% в упаковках.
Противотуберкулезный препарат тиоуреидоиминометилпиридиния перхлорат в принципе производит одна компания — «Фармасинтез» под брендом «Перхлозон». Иркутский производитель также использует собственную субстанцию.
При закупке остальных девяти препаратов — абакавир, атазанавир, зидовудин, зидовудин+ламивудин, иматиниб, лопинавир+ритонавир, протионамид, тенофовир, эфавиренз — в случае действия «второго лишнего» на торгах смогут конкурировать несколько компаний, производящих препараты из отечественных субстанций.
«Фармасинтез» производит все эти лекарственные средства, используя собственную АФС, изготовленную на заводе «БратскХимСинтез».
Семь препаратов из списка по полному циклу также производит «Р-Фарм». Субстанции для них изготавливаются на заводах компании «Фармославль» и «Технология лекарств». Абакавир, зидовудин, лопинавир+ритонавир, эфавиренз также производит «Дальхимфарм» из собственных субстанций.
Самые конкурентные торги намечаются при закупке иматиниба, так как его производство полностью локализовали шесть компаний: «Озон», «Нанофарма Девелопмент», «Фармасинтез», «Р-Фарм», «Фарм-Синтез», «Фармстандарт».
Но уже сейчас, по данным AlphaRM, большую долю закупок всех девяти МНН в рублях составляют препараты «Фармасинтеза». Так, по итогам 2020 года компания поставила почти весь объем атазанавира в госсегменте — 99,2% в рублях и столько же в упаковках. Доля компании при закупке эфавиренза составила 90,8% в рублях и 90,9% в упаковках, а при закупке абакавира — 87% в рублях и 87,2% в упаковках.
Опасения рынка
«К нашему огромному сожалению, в очередной раз Минпромторг представил общественности абсолютно неприемлемый проект изменений в Постановление Правительства РФ № 1289, суть которого, если называть вещи своими именами, сводится к дальнейшему переделу рынка в пользу той же хорошо известной узкой группы производителей-бенефициаров, и без того уже сделавших ставку в своей бизнес-модели на полный цикл производства, включая синтез субстанций. Очень жаль, что не сделаны надлежащие выводы из печального администрирования проекта «Фарма-2020», — отметил исполнительный директор Ассоциации международных фармацевтических производителей (AIPM) Владимир Шипков. В целом очень много непрозрачности и подмены понятий вокруг того, что есть «производство полного цикла», перечня выбранных МНН, целеполагания и так называемого пилота, добавил Шипков.
Искусственная зависимость всей системы здравоохранения от ограниченного количества производителей препаратов полного цикла может увеличить нагрузку на бюджеты всех уровней, указал глава ассоциации «Фармацевтические инновации» («Инфарма») Вадим Кукава.
Производители, которые в дальнейшем не смогут участвовать в закупках, будут вынуждены сокращать объемы производства, пояснил Кукава. В результате это может сделать недоступным назначение определенных препаратов пациентам по жизненным показаниям, а также привести к увеличению стоимости и кризисным ситуациям, если производитель полного цикла не сможет закрыть всю потребность государства в лекарстве, отметил он.
Говоря о дискриминации производителей, генеральный директор Ассоциации российских фармацевтических производителей (АРФП) Виктор Дмитриев привел в пример компании Sanofi и Novo Nordisk, которые частично локализовали производство в России для производства инсулинов. Компании изготавливают препараты по полному циклу, используя свои собственные субстанции, но синтезированные на зарубежных площадках. «В случае введения «второго лишнего» участие этих компаний в торгах будет невозможными, так как Минпромторг считает их недостаточно российскими», — отметил Дмитриев.
В связи с этим новый механизм может привести к снижению иностранных инвестиций в отечественную фармотрасль, добавил глава АРФП. Ассоциация уже обратилась к главе Минпромторга Денису Мантурову и предложила организовать открытое обсуждение проекта постановления.
Выступая на XII Всероссийском конгрессе пациентов, директор Департамента развития фармацевтической и медицинской промышленности Дмитрий Галкин отметил, что министерство учитывает риски иностранных производителей, которые инвестировали в развитие производств ГЛФ на территории России. «Чтобы они не оказались одномоментно ограничены, есть понимание, что всем точно надо дать время пересмотреть бизнес-стратегию. Необходимо время, чтобы наладить соответствующее производство», — сказал Галкин.
Реальность производства
По традиции строгость закона нивелируется необязательностью его исполнения, замечает директор по развитию компании RNC Pharma Николай Беспалов. К сожалению, некоторые российские компании занимаются «псевдопроизводством» субстанций, указал он. «Они не синтезируют молекулу, а завозят сырье технического класса чистоты. Затем оно проходит очистку либо просто переоформляется документация, и продукт поступает в обращение как сырье уже российского происхождения», — пояснил Беспалов.
На госторгах, чтобы подтвердить, что заявитель предлагает препарат, произведенный по полному циклу в России, и имеет право на преференцию, заказчик ориентируется исключительно на формальные признаки — наличие субстанции в госреестре и указание в заявке сведений о документе СП и заключении GMP, пояснил независимый эксперт по госзакупкам Алексей Федоров. Документ СП, который выдает Минпромторг, содержит сведения о стадиях технологического процесса производства лекарственного средства, осуществляемых на территории ЕАЭС. Он является подтверждением того, что препарат произведен на территории России по полному циклу, включая субстанцию, отметил эксперт.
Документ СП может быть выдан на основании предъявленных заявителем документов без проверки производства, отметила исполнительный директор Союза профессиональных фармацевтических организаций (СПФО) Лилия Титова. «Но если вводятся более жесткие условия, фактически предоставляя монопольные условия для определенных производителей, то и проверка полного цикла производства субстанций должна быть более жестко регламентирована», — указала она. К тому же, по мнению Титовой, необходимо законодательно закрепить определение полного цикла производства субстанций, чтобы в это понятие не входила, например, очистка сырья.
В пресс-службе Минпромторга отметили, что по закону заказчик обязан в одностороннем порядке отказаться от исполнения контракта, если выяснится, что поставщик или товар не соответствуют установленным требованиям.
«В рамках механизма выдачи СП уже предусмотрена комплексная и полноценная оценка возможности осуществлять конкретные стадии производства заявленного лекарственного средства, а также действуют превентивные и практикуемые механизмы нивелирования рисков нарушений при применении документа СП», — сообщили в пресс-службе министерства. Там также отметили, что Минпромторг открыт для конструктивных предложений по доработке механизма выдачи документа СП.
По мнению Семенова, в рамках внедрения «второго лишнего» должна быть создана прозрачная система контроля, согласно которой Минпромторг будет проводить обязательный аудит предприятий, желающих получить документ СП, чтобы убедиться, что они действительно синтезируют субстанцию.
В большинстве случаев российским производителям экономически не выгодно организовывать синтез субстанций, отметил Беспалов. В регистрационное удостоверение на препарат могут быть включены одновременно несколько АФС разных производителей.
Установить, из какой субстанции произведена конкретная серия готовой лекарственной формы, возможно, но это может сделать только специалист, задействуя информацию из разных источников, пояснил эксперт. «Масштабно по всему рынку подобные исследования никто не проводит», — уточнил он.































Нет комментариев
Комментариев: