К нам едет фармаконадзор
Всемирная организация здравоохранения
Вступившие в силу в марте 2017 г. Правила надлежащей аптечной практики лекарственных препаратов вслед за Федеральным законом № 61 «Об обращении лекарственных средств» напомнили, что фармацевты как субъекты обращения лекарственных средств являются полноправными участниками системы фармаконадзора.
Гарантия безопасности?
Самое большое заблуждение — считать, что регистрация препарата является гарантией его безопасности. Во многих странах мира усиленный надзор начинается сразу после одобрения препарата. Чем меньше препарат на рынке — тем больше внимания уделяется ему как со стороны регуляторных органов, так и со стороны компании-производителя. Почему?
Три фазы обязательных клинических исследований охватывают в лучшем случае несколько тысяч человек, отобранных по определенным критериям. Они не могут дать полное представление о профиле безопасности нового препарата. Например, если речь идет о редкой нежелательной реакции, которая встречается у одного на 10 тыс. человек, лекарственный препарат должны принять порядка 30 тыс. человек1. Это в среднем в 10 раз больше, чем пациентов, принимавших его до регистрации во время проведения клинических исследований.
После одобрения или регистрации информация об особенностях метаболизма препарата у людей с хроническими заболеваниями, детей, пожилых пациентов, людей с генетическими особенностями, как правило, неполная или отсутствует. До конца не изучены реакции лекарственного взаимодействия и неизвестны отдаленные последствия применения.
Вот почему любой новый препарат всегда несет потенциальные риски.
Так что такое фармаконадзор?
Главная идеология фармаконадзора — рациональное и безопасное использование лекарств.
Для этого проводят активные действия — обучение потребителей и участников обращения лекарственных средств, выявление, сбор, анализ, дальнейшую оценку нежелательных побочных реакций (НПР) или любых других проблем, связанных с лекарствами, находящимися на рынке. Это и есть фармаконадзор.
Весь комплекс мероприятий проводится с главной целью — выявление новой информации о рисках применения и предотвращение развития НПР у пациентов.
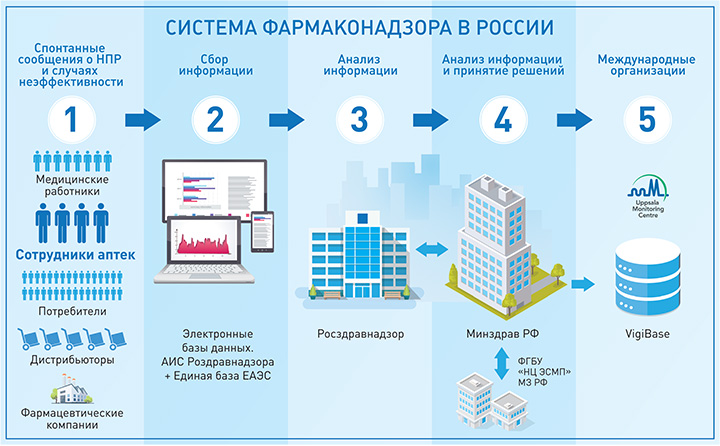
Фармаконадзор только про побочные эффекты?
Наряду с НПР фиксируются случаи неэффективности лекарственных препаратов или развития резистентности при лечении инфекционных заболеваний. Злоупотребление, назначение препарата, когда он противопоказан (например, детям, беременным, пациентам с определенными заболеваниями) или когда его применение не соответствует утвержденной инструкции по медицинскому применению в показаниях, дозе, длительности приема или в любой другой ее части — off-label — также входит в сферу интересов фармаконадзора.
Кроме того, по причине потенциальной угрозы здоровью человека необходимо фиксировать все случаи взаимодействия лекарств или лекарства с продуктами питания и БАД.
В некоторых ситуациях НПР или неэффективность препарата может быть вызвана проблемами качества или приемом фальсифицированного препарата.
Описанные выше случаи необходимо фиксировать, сведения сообщать в регуляторные органы.
Что же такое нежелательная побочная реакция?
Это любая неблагоприятная и непреднамеренная реакция организма, возникающая при применении лекарственного препарата1.
Реакция считается связанной с лекарственным препаратом, если причинно-следственную связь с приемом препарата исключить нельзя1.
Продолжение в одном из следующих номеров «ФВ».
______________________
1) Мониторинг безопасности лекарственных препаратов в вопросах и ответах. Брошюра для специалистов здравоохранения. Федеральная служба по надзору в сфере здравоохранения. Ассоциация международных фармацевтических производителей. 2014.
2) Безопасность лекарственных средств: неблагоприятные реакции на лекарства. Информационный бюллетень № 293. Март 2014 г. http://www.who.int/mediacentre/factsheets/fs293/ru/.






























Нет комментариев
Комментариев: