По две или по пять?
Что это такое?
Это научное исследование с участием людей. Для чего оно нужно? В случае, если речь идет о новом препарате, клинические исследования отвечают на два важных вопроса:
• Безопасно ли новое лекарство для человека?
Не существует абсолютно безопасных лекарств, как не существует лекарств, которые бы действовали на всех одинаково. Клиническое исследование должно ответить на вопрос: преимущества от использования нового ЛП превышают возможные риски?
• Эффективно ли новое лекарство у людей?
«Работает» ли препарат у людей? Насколько хорошо? Он лучше, чем терапия, которая сейчас используется в качестве стандартной в этой ситуации? Или препарат не превосходит по эффективности существующие методы лечения, но при этом оказывает существенно меньше побочных эффектов? Или он «работает» у определенной группы людей?
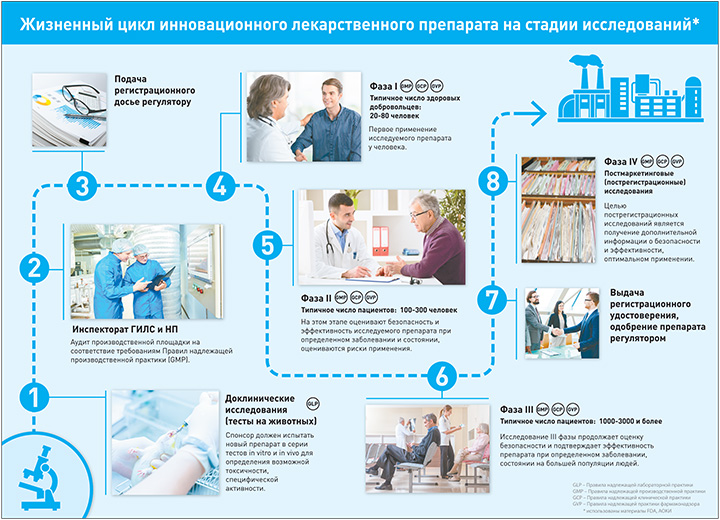
Ответы на эти вопросы дают разные фазы клинических исследований. Каждая фаза имеет свою цель, свои задачи, свои вопросы, которые помогают получить ответ на самый главный вопрос: может ли в дальнейшем препарат быть одобрен для широкого применения?
Знать фазы «в лицо»
Надо сказать, что любому применению нового препарата у людей предшествуют кропотливые доклинические исследования.
Доклинические исследования
Большая их часть — это испытания на животных. Хотя некоторые обязательные процедуры проходят in vitro в лабораториях.
Доклинические исследования дают первые ответы на вопросы:
- Токсично ли новое соединение?
- Каков «коридор» нетоксичных доз?
- Кумулируется ли соединение в организме?
- Что происходит при ежедневном приеме в течение месяца?
- Как «движется» молекула в организме при разных путях введения?
Кроме того, доклинические исследования дают информацию о мутагенности и канцерогенности соединения, о том, какое специфическое действие вещество оказывает на организм. Но главное — доклиническое исследование дает первое понимание о дозах вещества, которые в дальнейшем изучаются у человека.
I фаза
Первое применение препарата у человека. Как правило, в I фазе препарат получают небольшое количество здоровых добровольцев. Речь идет о 20—80 участниках. Цель первой фазы — оценить безопасность применения, переносимость, выявить побочные эффекты.
В онкологии или в случае редких заболеваний I фаза может проходить с участием пациентов.
II фаза
В большинстве исследований это первое применение препарата при определенном заболевании или состоянии. Оно проводится на ограниченном количестве пациентов — около 100—300. Часто — с плацебо-контролем.
Помимо главных целей — оценки краткосрочной безопасности, выяснения, действительно ли препарат «работает» при данном заболевании, происходит подбор эффективных доз. Именно в этой фазе решается вопрос: «по две или по пять?», но окончательный ответ на вопрос о режиме дозирования дает III фаза.
Эту фазу называют «убийцей» препаратов. После нее решается стратегический вопрос: стоит ли проводить разработку препарата дальше?
III фаза
Решающее исследование на большом количестве пациентов, которое исчисляется тысячами человек. Цель — подтвердить эффективность в большой популяции, сравнить со стандартными или эквивалентными методами лечения, выявить наиболее частые побочные эффекты и лекарственные взаимодействия.
Данные, полученные в клинических исследованиях III фазы — схемы и длительность терапии, побочные эффекты, как раз и станут основой инструкции по медицинскому применению препарата. По результатам III фазы станет ясно, «по две или по пять».
IV фаза
После регистрации препарата начинается следующий этап жизненного цикла препарата. На этом этапе стремятся получить наиболее полную информации о рисках, пользе и оптимальном использовании препарата.
Плацебо: все познается в сравнении
Плацебо — это быстрый и надежный способ выявить, «работает» ли новое лекарство. Однако плацебо не используют, если это сопряжено с рисками для пациентов. Нельзя оставить пациента без лечения, если клиническая ситуация требует того. Потому что основная идеология любого клинического исследования, изложенная в Хельсинкской декларации, — интересы и благополучие человека всегда должны превалировать над интересами науки и общества.






























Нет комментариев
Комментариев: