Число международных многоцентровых клинических исследований сократилось почти на 93%
Рынок клинических исследований (КИ) в России в первом полугодии 2023 года сохранил привычный объем. Об этом говорится в исследовании Ассоциации организаций по клиническим исследованиям (АОКИ). В среднем в 2012–2023 годы за первую половину года редко выдавалось более 400 разрешений и никогда – меньше 300. Первое полугодие 2023 года проигрывает аналогичному периоду 2022 года, который вошел в тройку самых результативных за время наблюдений АОКИ.
Правда, как говорится в отчете ассоциации, многие из разрешений на ММКИ, выданных в 2022 году, остались на бумаге, сами исследования не стартовали, но формально показатель января — июня 2022 года остается высоким.
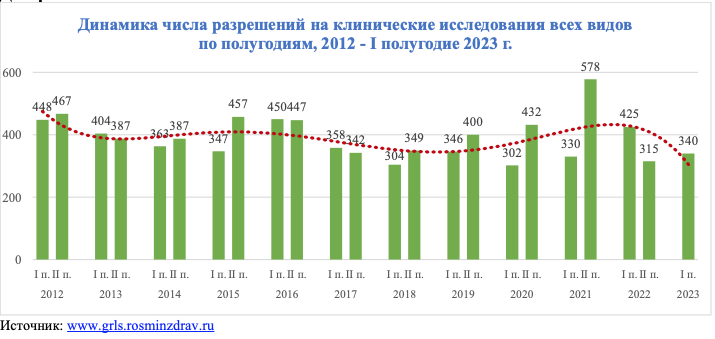
Число международных многоцентровых клинических исследований (ММКИ) сократилось драматически – на 92,8%. В I полугодии прошлого года, когда одобрялись преимущественно заявления, поданные еще до февраля 2022 года, было выдано 111 разрешений на проведение ММКИ. За первую половину 2023 года одобрено всего восемь новых международных исследований, их доля в общем количестве КИ составила всего 2,4%.
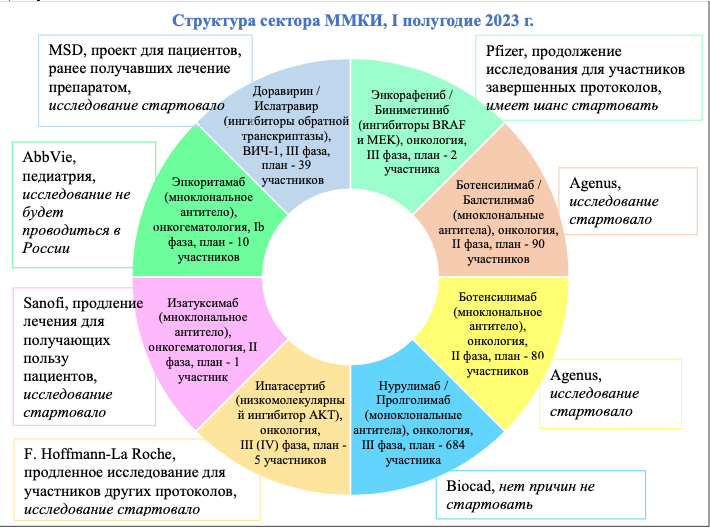
В АОКИ обратили внимание, что в реестре Минздрава к ММКИ отнесены 16 разрешений. Однако ассоциация к международным исследованиям относит только те, информацию о которых можно найти в международных базах данных ClinicalTrials.gov, EU Clinical Trials Register. В этих базах нашлось только восемь исследований.
При этом, по данным АОКИ, как минимум одно исследование из них проводиться в России не будет. Речь идет об AbbVie, которая подавала заявку на проведение ММКИ по протоколу «Открытое, в одной группе, фазы 1b исследование Эпкоритамаба у детей с рецидивирующими/рефрактерными агрессивными зрелыми В-клеточными новообразованиями» еще до февраля 2022 года. На получение разрешения ушло больше года. «За это время интерес спонсора к участию российских центров в проекте потерял актуальность», – отмечается в отчете АОКИ.
Еще четыре ММКИ представляют собой так называемые «продолженные исследования», в которых принимают участие пациенты, участвовавшие в предыдущих исследованиях компании с тем же препаратом. Такого рода проекты, как правило, включают небольшое число пациентов (в данном случае это один, два, пять и 39 человек). Три из этих четырех исследований, согласно информации АОКИ, уже стартовали, еще одно планируется к старту.
Два ММКИ представляют собой полноценные международные исследования II фазы – это исследования американской компании Agenus, в которых планируется изучение моноклонального препарата ботенсилимаб, отдельно и в комбинации с балстилимабом, с привлечением 80 и 90 онкопациентов. Оба исследования, как полагают в АОКИ, уже начаты.
Спонсором восьмого исследования по протоколу «Рандомизированное исследование эффективности и безопасности неоадъювантной терапии препаратом BCD-217 (нурулимаб + пролголимаб) в сравнении со стандартной адъювантной терапией пембролизумабом у пациентов с резектабельной меланомой кожи III стадии» стала российская компания «Биокад». Оно заявлено как ММКИ, но будет проводиться только в России и Белоруссии.
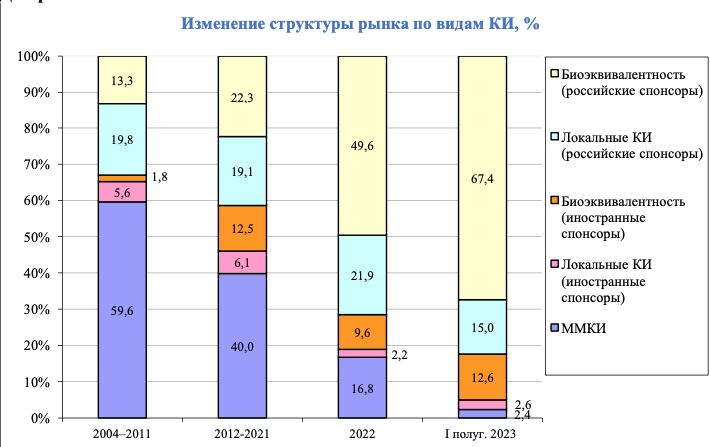
Количество иностранных компаний, которые проводят локальные КИ и исследования биоэквивалентности, сопоставимо с прошлогодними показателями. В первом полугодии 2023 года было девять локальных проектов, в первом полугодии 2022 года – десять, исследований на биоэквивалентность и в первой половине 2023, и в первой половине 2022 года было по 43.
Число разрешений на локальные исследования терапевтической эффективности и безопасности российских препаратов сократилось с 90 в первом полугодии 2022 года до 51 в первом полугодии 2023 года. В то же время выросло число исследований биоэквивалентности отечественных дженериков: 229 против 171 годом ранее. Биоэквивалентность российских спонсоров – единственный вид исследований, стабильно растущий в 2020-е годы.
Среди терапевтических областей самой популярной у производителей воспроизведенных препаратов была кардиология и сердечно-сосудистые заболевания (ССЗ). Зарубежными спонсорами было одобрено 17 протоколов в этой области, российские производители дженериков получили 66 разрешений в этой области. Это произошло благодаря популярности конкретных молекул: ривароксабана (20 разрешений за полугодие), апиксабана (восемь), индапамида и периндоприла (по семь, тестировались преимущественно в комбинациях). Из не применяющихся в кардиологии веществ наибольший интерес у производителей воспроизведенных препаратов вызвало противодиабетическое средство вилдаглиптин (семь протоколов).






























Нет комментариев
Комментариев: