UPD Не трогай, это на новый год!
Как выходят инновационные лекарства на российский рынок после февраля 2022 года

Как мы считали
Мы относили к вышедшим на рынок препараты, получившие разрешение на гражданский оборот и разрешение на ввоз по Постановлению Правительства РФ № 593 от 05.04.2022 при дефиците лекарства.
Мы не учитывали, что некоторые из препаратов в небольших объемах закупались, будучи незарегистрированными. Также мы не учитывали лекарства из перечней и закупок фонда «Круг добра» из-за слишком малых объемов.
Для анализа ситуации «ФВ» использовал данные двух государственных реестров: лекарственных средств Минздрава (ГРЛС) и Росздравнадзора о вводе в гражданский оборот.
Для лучшего понимания процессов собраны данные за пять лет, которые охватывают период с 2019-го по 2023 год. Последний ограничен данными по 1 декабря.
Из ГРЛС получена информация о регистрации, начале процедуры (если проходила по национальному законодательству), клинических исследованиях и лекарствах, ввозимых по постановлению № 593.
Данные о разрешениях на гражданский оборот и датах первого решения мы получили в реестре Росздравнадзора. Лекарства, входящие в перечни фонда «Круг добра», взяты с официального сайта фонда. Фактические закупки фонда — ФЦПиЛО.
Поступление препаратов на рынок проверили по данным AlphaRM — они совпали, из вышедших в гражданский оборот лекарств не было сведений только по продажам «Табректы».
Как инновационные лекарства попадают на рынокПуть инновационного препарата к пациенту — долгий и включает три важных этапа, каждый из которых длится от нескольких месяцев до нескольких лет. Самый продолжительный этап — клинические исследования, занимает несколько лет. Оригинальное лекарство проходит обязательные три фазы испытаний с участием добровольцев и пациентов. Условие для регистрации — участие российских пациентов в исследованиях — определено законодательством. Второй этап — регистрация лекарств в Минздраве. По правилам Евразийского экономического союза (ЕАЭС), подача досье по которым преобладает с 2022 года, регистрация занимает в среднем один год, но фактически может длиться дольше. После регистрации производитель должен получить от Росздравнадзора разрешение на гражданский оборот. Существует альтернативный путь — при дефиците и риске его возникновения лекарство может завозиться в иностранной упаковке по разрешению Минздрава на основании Постановления Правительства РФ № 593 от 05.04.2022. Для небольшой части пациентов инновационное лекарство может стать доступным при внесении в перечень правительственного фонда «Круг добра». |
Как регистрировали оригинальные лекарства
В 2022 году Минздрав выдал рекордное за последние пять лет число регистрационных удостоверений зарубежным компаниям, выводящим на рынок оригинальные препараты, — 28. Это выше, чем в спокойный допандемийный 2019 год. Тогда зарегистрировали 25 инновационных лекарств иностранных производителей.
Ситуация с регистрацией оригинальных иностранных препаратов в 2023 году почти полностью повторяет прошлый: за 11 месяцев Минздрав одобрил 24 инновационных лекарства. В 2022 году за аналогичный период выдано 26 регистрационных удостоверений.
Но сама по себе регистрация не отражает решение западных компаний о выводе на российский рынок инновационных лекарств после введения санкций. Процесс регистрации мог начаться за год до получения решения, с учетом пандемии и более медленного протекания процессов — даже раньше.
«ФВ» обнаружил три препарата, подача документов на регистрацию которых состоялась еще в 2020 году. Положительные решения по ним были приняты Минздравом в январе, ноябре 2022-го и в апреле 2023 года. Это противоопухолевый «Айклусиг» и препарат для лечения анемии при бета-талассемии «Реблозил», которые на рынок так и не вышли, а также противоопухолевый «Милотарг», получивший разрешение на гражданский оборот.
Большая часть оригинальных лекарств, одобренных Минздравом в 2019—2021 годах, продолжает поступать на российский рынок. Это следует из реестра Росздравнадзора о выдаче разрешений на гражданский оборот. Из 70 оригинальных иностранных лекарств 55 находятся в гражданском обороте. Девять препаратов после получения регистрационного удостоверения на российский рынок не поступали вообще.
Как оригинальные иностранные лекарства выходили на рынок
Регистрация препарата не означает выход на рынок и доступность для пациентов. Основной канал поступления — получение разрешения на гражданский оборот компанией-производителем. Лекарства также могут ввозиться по особому разрешению Минздрава в случае дефицита.
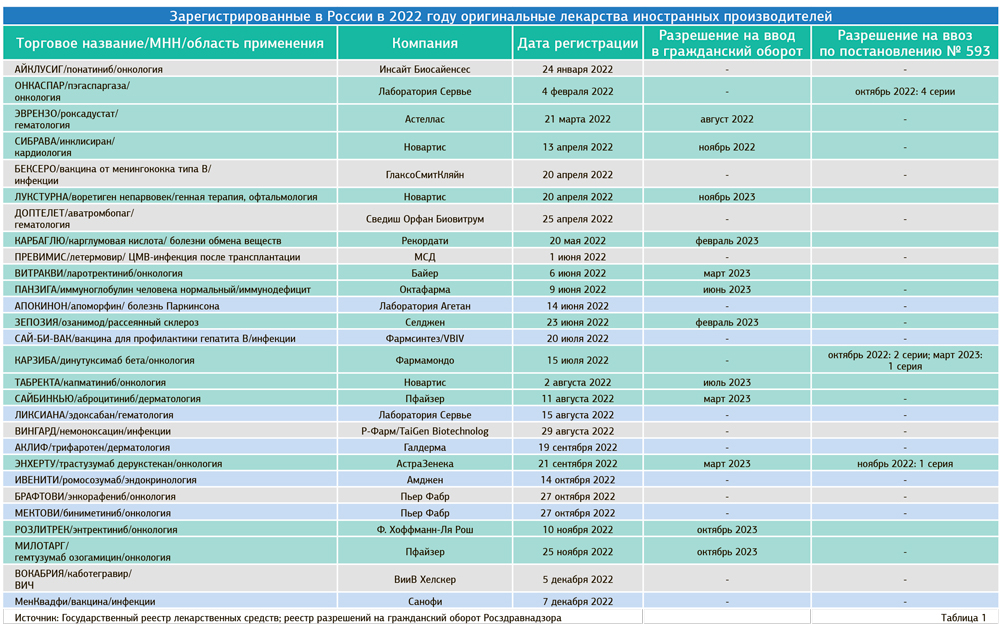
Из 28 одобренных Минздравом в 2022 году оригинальных иностранных препаратов для пациентов стали доступны 14 (рис. 1, табл. 1). Непосредственно в 2022 году из них на рынок вышло всего два (рис. 2). Это не типичная ситуация. Позднее получение первого разрешения на гражданский оборот стало особенностью первого года санкций.


В среднем это заняло больше девяти месяцев. Введение санкций, изменение логистических схем и геополитической ситуации сильнее отразилось на сроках получения разрешения на гражданский оборот и выход на рынок, чем пандемия. В первый и второй год COVID-19 у иностранных компаний уходило восемь и шесть месяцев соответственно.
Для сравнения: в первой половине 2019 года от момента регистрации до получения первого разрешения на гражданский оборот уходило в среднем четыре месяца.
В 2022 году на рынок вышли ожидаемый препарат «Сибрава» от «Новартис» для лечения наследственных нарушений обмена холестерина с инновационным механизмом действия и «Эврензо» компании «Астеллас» для лечения анемии при хронической болезни почек.
Подавляющее число препаратов — 10 из 12, зарегистрированных в 2022 году, получили разрешение на гражданский оборот только в 2023-м. Пока абсолютный рекордсмен по позднему выходу в гражданский оборот — инновационный препарат генной терапии «Лукстурна» компании «Новартис». Разрешение получено спустя 19 месяцев после регистрации в России. Сопоставимо долгим был выход на рынок иммуноглобулина для больных иммунодефицитом с недостаточностью антител «Панзига» от «Октафарма» — 12 месяцев после получения регистрационного удостоверения. Похожий срок поступления на рынок двух противоопухолевых препаратов от компаний «Новартис» и «Пфайзер» — 11 месяцев.
Три онкологических препарата — «Онкаспар», «Энхерту» и «Карзиба», несмотря на получение регистрационных удостоверений в 2022 году, были признаны дефицитными и ввезены осенью того же года в иностранных упаковках по постановлению № 593 и решению Минздрава.
Регистрационное удостоверение препарата «Онкаспар» было отозвано в 2019 году прежним владельцем — компанией «Медак» — в связи с передачей прав «Сервье» после покупки портфеля онкопрепаратов. Новый владелец вновь зарегистрировал «Онкаспар» в 2022 году уже по правилам ЕАЭС.
«Энхерту» вскоре получил разрешение на гражданский оборот и поступил на рынок, «Онкаспар» — нет. «Карзибу» закупает правительственный фонд «Круг добра».
Ситуация с выходом на рынок одобренных в 2023 году оригинальных лекарств складывается немногим лучше, чем в предыдущем.
По итогам 11 месяцев на рынок вышли пять препаратов из 24, регистрация которых завершилась в первой половине года (рис. 2, табл. 2).
В рекордно короткие сроки в гражданский оборот поступил препарат «Сафнело» компании «АстраЗенека» для лечения системной красной волчанки с инновационным механизмом действия. Разрешение на гражданский оборот также получил «Нексвиазайм» для лечения болезни Помпе.
Первое антитело, воздействующее сразу на две мишени и пути развития заболеваний сетчатки, вывела в гражданский оборот компания «Ф. Хоффман-Ля Рош» (препарат «Вабисмо»).
Получивший регистрационное удостоверение препарат «Трикафта» для лечения муковисцидоза внесен в перечень фонда «Круг добра».
За последние два года на российский рынок не вышла ни одна из четырех зарегистрированных зарубежных вакцин: две для профилактики менингококковой инфекции от «ГлаксоСмитКляйн» и «Санофи», одна от «ГлаксоСмитКляйн» против опоясывающего герпеса и одна против гепатита В от компании VBIV, правами на дистрибуцию и регистрационным удостоверением в России владеет «Фармсинтез». Компания «МСД Фармасьютикалс» даже вывела с российского рынка недавно зарегистрированную вакцину от ветряной оспы «Варивакс».

Инновационные зарубежные препараты, как правило, дорогие, и выводить их на рынок без включения в программы госгарантий не имеет смысла, замечает сопредседатель Всероссийского союза пациентов Юрий Жулев: «Если попасть в Перечень ЖНВЛП не светит, никто не гарантирует массовые закупки этих медикаментов. Следовательно, везти это все, а логистика сейчас, кстати, тоже очень недешевая, чтобы оно тут стухло, никому не нужно».
В Перечень ЖНВЛП на 2023 год включены только пять новых препаратов, хотя в конце 2021-го и в течение 2022 года комиссия Минздрава по формированию лекарственных перечней одобрила 19. Перечень для программы ВЗН планировалось пополнить тремя лекарствами, но не включили ни один.
Уже два года в перечень крайне неохотно включают инновационные лекарства, причем не только иностранные, но и российские, подчеркнул Жулев: «Мы поднимали эту тему на Всероссийском конгрессе пациентов 22 ноября. Ситуация складывается не лучшим образом. Есть десятки тысяч пациентов, у которых уже был бы шанс, если бы новые препараты поступили на рынок и стали закупаться. Но этого не происходит».
«На рынке традиционно хватает проблем. Это и слабая охрана интеллекутальной собственности, и задержка с включением препаратов в перечни в последние несколько лет. Но все они не настолько критичны, чтобы не выводить препараты на рынок», — полагает директор ассоциации «Фармацевтические инновации» («Инфарма») Вадим Кукава.
Он заметил, что судить о причинах, из-за которых сложилась такая ситуация, очень сложно, и подчеркнул, что не видит в ней политической воли. «По моему мнению, компании не стали бы регистрировать препараты без намерения вывести их на рынок. Но все же они хотят каких-то гарантий», — резюмировал он.
Позиция западных компаний будет понятна только в 2024 году, когда пройдет период, который в среднем тратят на первое разрешение на гражданский оборот.
Но уже сейчас можно увидеть следующую тенденцию: из препаратов, зарегистрированных в 2019-м и 2020 году, на рынок не вышло только три лекарства. Из зарегистрированных в 2021 году для пациентов остались недоступны уже шесть лекарств, в 2022-м — 14.
Ответы компаний
«Галдерма»
В компании «Галдерма» подтвердили «ФВ», что планируют вывести препарат «Аклиф» на рынок. «Спасибо за проявленный интерес. Как только появится информация по вводу препарата в гражданский оборот, мы сделаем об этом соответствующее заявление в СМИ», — указали в компании.
«Пьер Фабр»
Компания «Пьер Фабр» уже ожидает одобрения Министерства здравоохранения обновленной информации по препаратам «Брафтови» и «Мектови». Они будут введены в гражданский оборот в самое ближайшее время, сообщили «ФВ» в пресс-службе производителя.
«ГлаксоСмитКлайн»
Планы по выводу препаратов «Бексеро», «Шингрикс» и «Зеюла» также подтвердили в компании GSK. «Обеспечение доступности препарата является длительным процессом, требующим надлежащего планирования для его вывода в гражданский оборот. Сроки вывода указанных лекарственных препаратов — 2024—2025 годы», — сообщили в пресс-службе.
«Сервье»
Потребности отечественного здравоохранения в «Онкаспаре» обеспечены ввозом препарата в Россию в иностранной упаковке с маркировкой на английском языке на основании заключения межведомственной комиссии (МВК), согласно положениям Постановления Правительства РФ № 593 от 05.04.2022, заявили в компании. «Тем самым подтверждаем, что лекарственный препарат «Онкаспар» введен в обращение России на основании заключения МВК. В подобных случаях положения статьи 52.1 Федерального закона № 61 (61-ФЗ) «Об обращении лекарственных средств» по выполнению действий для ввода в гражданский оборот не применимы», — заявила директор по фармацевтической деятельности по странам ЕАЭС компании Наталья Чукреева. Она также отметила, что для будущих поставок иных оригинальных орфанных лекарственных препаратов с новой регистрацией в России компания внесла в профильную отраслевую профессиональную ассоциацию предложение инициировать изменение в 61-ФЗ «Об обращении лекарственных средств» и допустить ввоз и обращение в России зарегистрированных оригинальных орфанных и(или) высокотехнологичных лекарственных препаратов в течение 12 месяцев после даты их регистрации в нашей стране в упаковках, предназначенных для обращения в иностранных государствах. «С чрезвычайной заинтересованностью мы мониторируем продвижение рассмотрения в Госдуме России как вышеуказанного изменения, так и принципов признания лекарственного препарата орфанным, в том числе и для регистрации по правилам ЕАЭС, среди иных изменений в 61-ФЗ «Об обращении лекарственных средств».
По препарату «Ликсиан» (эдоксабан) процесс вывода в гражданский оборот идет, а «Лусефи» (лусеоглифлозин) получил РУ всего месяц назад, также отметили в компании. «Ввиду столь недавнего одобрения лекарственного препарата в России, последующие действия находятся на этапе планирования», — резюмировала Чукреева.
«Лаборатория Агетан»
Представитель компании в России — ГК «Мир-Фарм» сообщила «ФВ», что не выводит на рынок препарат «Апокинон», так как пока не зарегистрированы помпы для его использования. «После регистрации и закупки помп завезем ампулы «Апокинона», упакуем, промаркируем, проведем выпускающий контроль, сдадим на анализ в лабораторию Росздравнадзора и получим протокол анализа, только после этого введем в оборот», — заявили в компании.
«Фармамондо»
Одна из причин задержек с выводом препарата «Карзиба» заключается в том, что в процессе регистрации иностранный производитель сменил одну из производственных площадок, сообщили в ООО «Фармамондо». Там также добавили, что во избежание отсутствия препарата на российским рынке, компания получила разрешение на временное обращение «Карзибы» в иностранной упаковке в рамках Постановления Правительства РФ № 593 от 05.04.2022. Сейчас компания находится на заключительном этапе ввода в гражданский оборот первой партии препарата «Карзиба».
«Вифор Фрезениус»
Лекарственный препарат «Вельтасса» не введен в гражданский оборот, так как на данный момент не завершены необходимые регуляторные процессы, сообщили «ФВ» в пресс-службе Vifor Pharma. В компании не уточнили сроки их завершения.
«Свикс Хэлскеа»
В ООО «Свикс Хэлскеа», которое с июня 2022 года выступает в качестве официального представителя Bristol Myers Squibb, сообщили, что «предпринимают все необходимые действия для поддержания и обеспечения доступа российских пациентов ко всему портфелю лекарственных препаратов Bristol Myers Squibb, в том числе и к лекарственным препаратам «Реблозил» и «Инребик». Также в компании подтвердили, что ведут работы по выводу препарата «Рецевмо» на российский рынок. ООО «Свикс Хэлскеа» получило РУ на препарат в конце 2023 года от Eli Lilly.
«Ф. Хоффман-Ля Рош»
Компания Roche в свою очередь сообщила, что «коммерческая доступность» препарата «Лансумио» в России ожидается в середине 2024 года.
«Джонсон&Джонсон»
Ввоз первых серий препарата «Балверса» в Россию запланирован в начале 2024 года, сообщили в «Джонсон&Джонсон». «В соответствии с требованиями российского законодательства и в рамках стандартного процесса, в аккредитованных федеральных государственных бюджетных учреждениях будут проводиться испытания ввезенных серий препарата по показателям качества, предусмотренным нормативной документацией. По итогам испытаний мы ожидаем, что препарат будет доступен на складе в РФ для закупки во II квартале 2024 года».
«АстраЗенека»
«АстраЗенека» сообщила, что работает над поставками препаратов «Тезспире» и «Имджудо». Препараты будут введены в гражданский оборот после прохождения обязательного контроля качества в лаборатории Росздравнадзора согласно требованиям российского законодательства.































Нет комментариев
Комментариев: